在金属催化的不对称反应中,手性配体起着至关重要的作用,其设计合成受到广泛关注。在过去几十年里,虽然出现了数以千计的各类手性配体,但通用性好的手性配体和金属催化剂仍为数不多。其中,南开大学周其林院士团队开创性地发展了一系列以螺二氢茚骨架为基础的手性螺环配体,在多种金属催化不对称反应中取得了优异的立体诱导效果,已成为在不对称氢化、碳-碳键形成以及碳-杂原子键形成等反应中应用广泛的一类优势配体。但是,光学纯全碳螺环配体中手性季碳的构建则十分困难,存在合成和拆分步骤繁琐等局限性。因此,如何从廉价易得的原料出发,发展相应手性螺环骨架的高效、不对称催化合成新方法,是非常迫切而且具有挑战性的课题。
中国科学院上海有机化学研究所金属有机化学国家重点实验室丁奎岭课题组长期致力于手性配体的设计、高效合成以及在不对称催化反应中的应用研究,该课题组曾以SpinPHOX/Ir为催化剂,通过α,α'-二(2-羟基亚芳基)酮的催化不对称氢化-缩酮化串联反应,首次实现了手性芳香螺缩酮化合物的不对称催化合成 (Angew. Chem. Int. Ed. 2012, 51, 936),并在此基础上发展了相应的系列螺环骨架手性双膦配体SKP(图一),随后进一步改进了合成方法,可以数十克的规模在实验室方便制备 (Adv. Synth. Catal. 2013, 2900)。目前,SKP系列配体已在Pd、Rh、Au、Cu等金属催化的多个不对称烯丙基化、烯烃环丙烷化、联烯多组分烷氧羰化胺化、烯烃氢化、羰基的炔丙基化等反应中表现出优秀的催化活性和立体选择性。
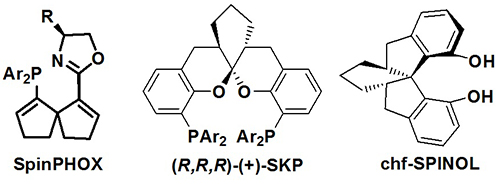
图一、手性配体SpinPHOX、SKP和chf-SPINOL
受上述双膦配体SKP中螺缩酮骨架不对称催化合成策略的启发,丁奎岭课题组最近设计并实现了光学活性环己烷稠合螺二氢茚骨架的高效、催化不对称合成。在该方法中,两分子芳基甲醛与环己酮在NaOH作用下缩合首先得到α,α'-二(亚芳基)酮,后者通过PHOX/Ir催化的不对称氢化和Lewis酸TiCl4促进的双重Friedel-Crafts反应,以良好的总收率和最高>99%的ee值获得一系列手性环己烷稠合螺二氢茚骨架(图二),成功的关键是Lewis酸TiCl4的选择,确保了在酮的Friedel-Crafts反应过程中羰基α-位的手性碳原子不会消旋。需要特别指出的是,配体合成的关键中间体可以通过一锅法高效制备,再施以简单转化即可以25克的规模高效获得近乎光学纯的环己烷稠合螺二氢茚二酚chf-SPINOL,整个过程不需柱色谱纯化,极大地方便了相应手性配体的实用合成。
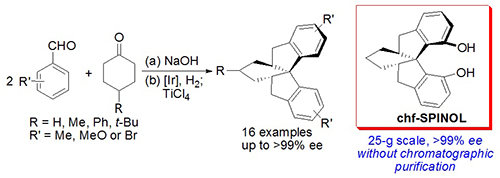
图二、环己烷稠合手性螺二氢茚化合物的不对称合成
以容易大量合成的chf-SPINOL为前体,通过简单转化可方便地衍生得到手性单齿亚膦酰胺配体6a-c及P^N^N三齿配体11(图三)。初步比较研究表明,这些配体分别在Rh、Ir和Au催化的不对称氢化、氢酰化、[2+2]环加成等反应中,均表现出优秀的催化活性和对映选择性,其性能水平与最好的同类配体或催化剂相当,特别是在(1S, 2S, 2'S)-11/Ir催化的苯乙酮的氢化反应中,TON可以达到100万,TOF为41,666/h, 反应的对映选择性高达98%,展现出良好的应用潜力。

图三、基于环己烷稠合手性螺二氢茚骨架的部分手性配体
该工作发表在最近出版的J. Am. Chem. Soc. 2018, 140, 10374-10381上, 相关中国发明专利CN201510974151.1和国际专利PCT Int. Appl. (2017), WO 2017107789 A1 20170629 已经授权浙江九州药业实施。上述工作得到国家自然科学基金会、科技部、中国科学院战略性先导科技专项(B类)和上海市科委的资助。
