在各种手性骨架中,轴手性螺二氢茚骨架已被视为一类“优势手性骨架”,但是碳中心的螺环骨架合成和改造仍具挑战。与碳相比,硅的原子半径更大 (Si vs C: 111 ppm vs 67 ppm),碳硅键键长更长 (C-Si vs C-C: 1.87 埃米 vs 1.53 埃米),同时硅中心螺环接近垂直的构像亦可能导致螺二氢苯并噻咯相较于碳中心螺二氢茚骨架更加刚性。螺二氢苯并噻咯骨架这些独特的性质决定了其衍生的手性催化剂或者配体可能具有与碳中心螺环衍生物不同的反应性质和手性诱导能力,并为手性配体和催化剂开发提供新的平台。然而,目前硅螺环骨架的不对称合成鲜有报道 (J. Am. Chem. Soc. 1996, 118, 12469; Angew. Chem. Int. Ed. 2013, 52, 1520; J. Org. Chem. 2015, 80, 5407)。
利用Rh催化分子内双氢硅化反应,以 (R,R)-Et-DuPhos或 (R)-QuinoxP作为手性配体,首次实现了螺二氢苯并噻咯衍生物高效和高立体选择性合成。随后,通过该方法可以以10克级规模、优异的收率 (90-99%)、非对映选择性 (dr = 96:4) 和对映选择性(ee = 99%)构建了配体平台分子的前体。通过X-ray单晶结构比较发现:硅中心螺环二酚SPSiOL与碳中心螺环二酚SPINOL相比,SPSiOL两个苯环之间有更大的二面角 (92.2o vs 64.2o),氧氧间距离更远 (5.155 埃米 vs 3.439 埃米)。鉴于两者结构上的显著差异可能产生不同的反应性质和手性诱导能力,他们从对映纯SPSiOL出发,进一步合成了一系列基于螺二氢苯并噻咯骨架的手性亚磷酰胺配体(SPSiPhos)。初步研究表明,SPSiPhos在Rh催化的氢化反应和Pd催化的分子内胺芳基化反应中都展现出优秀的手性诱导能力,验证了螺二氢苯并噻咯骨架在不对称催化中的潜力。该工作首次提出使用硅螺环作为手性骨架设计手性配体和催化剂,为进一步研究手性硅螺环结构在不对称催化中的应用奠定了基础。
文章的第一作者为硕士研究生常鑫。上述研究工作得到了国家自然科学基金委、中国科学院和上海有机所的资助。
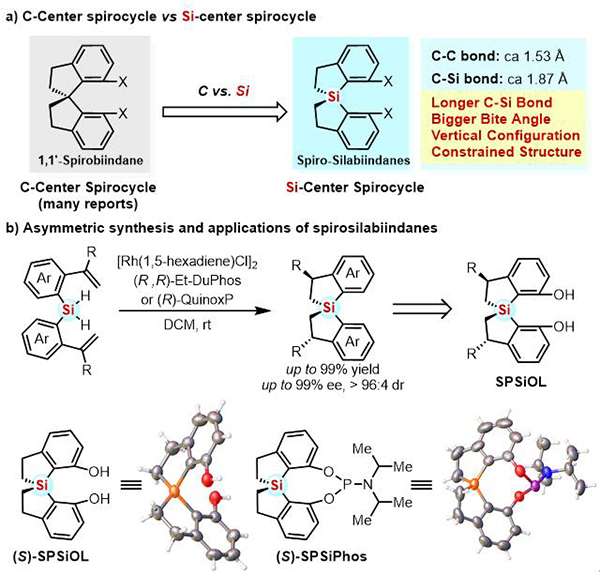
图 手性螺二氢苯并噻咯的不对称合成及应用
