金属室在环丙烯催化不对称氢官能团化方面取得研究进展
环丙烯的催化不对称氢官能团化反应是快速多样性地合成多取代手性环丙烷最高效的策略之一。在环丙烯的催化不对称氢官能团化反应中,利用高活性有机金属试剂,如格式试剂、有机锌试剂、有机铝试剂等,在环丙烯上引入无官能团的简单烷基,而利用官能团兼容性良好且稳定的试剂来进行环丙烯的不对称官能团化反应却少有报道。而手性多取代环丙烷是具有生物活性的药物分子和天然产物中常见结构片段,因此开发利用官能团兼容性好的试剂通过高原子经济性的反应过程实现催化不对称环丙烯官能团化非常必要。
中国科学院上海有机化学研究所金属有机化学国家重点实验室的孟繁柯课题组一直致力于钴催化的不对称反应研究。在前期研究中,孟繁柯课题组发现,廉价易得的高官能团兼容性的不同取代类型的烯基硼酸在二价钴双膦和碳酸钾的作用下,可以高效生成烯基钴物种,进而与环丙烯发生不对称氢烯基化反应,以高非对映选择性和对映选择性构建了手性烯基环丙烷的产物(Angew. Chem. Int. Ed. 2019, 58, 11049–11053)。
近期,该课题组将利用二价钴催化环丙醇通过β-碳碳键断裂产生的钴高烯醇络合物,用于环丙烯的不对称氢官能团化反应,取得了新的研究进展。(Angew. Chem. Int. Ed. 2021, 60, 2694–2698)
孟繁柯课题组发现,由于钴高烯醇中间体羰基的配位作用,使得其反应活性高于硼酸,即使在降温的条件下,反应也能高效进行。该反应产率优异,底物适用性广,一步可以引入含有羰基的烷基,以往很少在β-碳碳键断裂反应中研究的烯基和酯基取代环丙醇都适用于该反应,具有100%原子经济性。机理研究显示,碳钴键质子化过程是决速步,质子化过程中,碳钴键没有发生消旋。而且钴高烯醇络合物会发生可逆的烯醇化过程。反应产物可以进行后续官能团转化,酮羰基可以选择性转化成酯基或者氨基,方便快速构建手性环丙烷化合物库。
此项工作由黄巍同学完成。该研究得到国家自然科学基金委、上海市科委、中国科学院、上海有机所和金属有机化学国家重点实验室的大力资助。
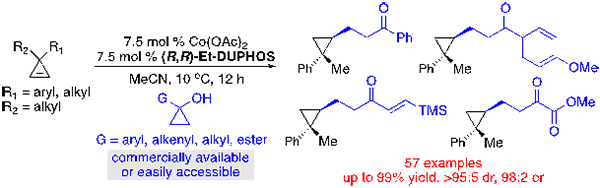
钴催化利用环丙醇对环丙烯的不对称氢烷基化反应
