金属室在铱催化Z式保留不对称烯丙基取代反应合成中环化合物方面取得进展
在许多天然产物、药物以及生物活性分子中都含有中环结构(七至十一元环),发展其高效合成方法具有重要的意义。然而由于跨环张力和不利的熵效应,目前中环分子的合成,特别是手性中环分子的不对称催化合成还存在很大的挑战,有效的方法局限于分子内环化反应、多环化合物扩环反应和多组分环化反应等。
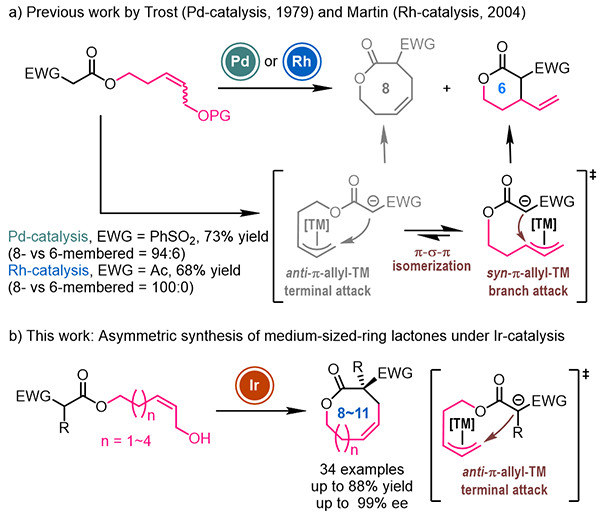
过渡金属催化的不对称烯丙基取代反应是构建碳-碳键和碳-杂键的重要方法。使用分子内不对称烯丙基取代反应可以合成含有烯烃片段的手性环状化合物。然而,由于构象限制,中环化合物(n元环)中烯烃一般为Z式构型。利用不对称烯丙基取代反应构建Z式烯烃需要在热力学较不稳定的anti-π-烯丙基金属中间体的末端发生亲核取代。然而anti-π-烯丙基金属中间体易于通过快速的“π-σ-π”异构化转化为热力学更稳定的syn-π-烯丙基金属中间体,随后接受亲核试剂进攻,得到小环产物(n-2元环)。因此利用不对称烯丙基取代反应合成手性中环化合物的报道十分有限(图1)。在1979年和2004年,Trost课题组和Martin课题组分别使用钯催化或铑催化分子内烯丙基取代反应实现了八元环分子的合成,但都还局限于消旋反应的研究。

图1 过渡金属催化不对称烯丙基取代反应合成中环化合物
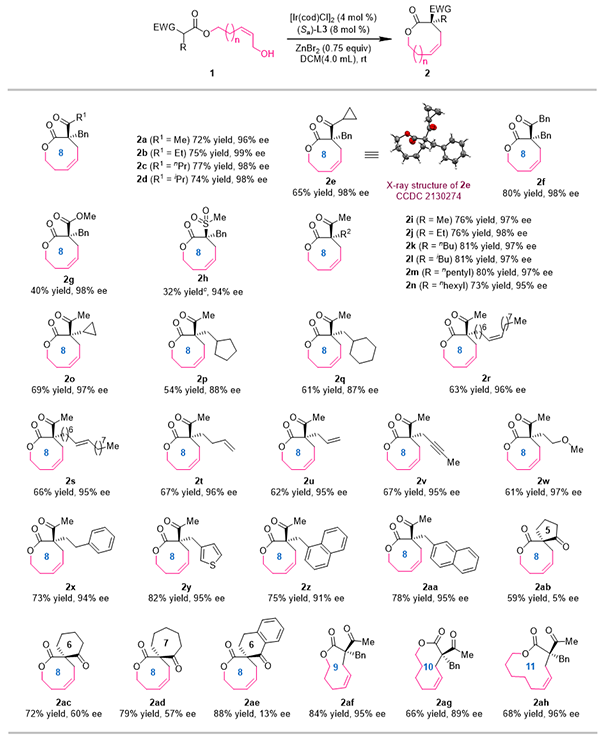
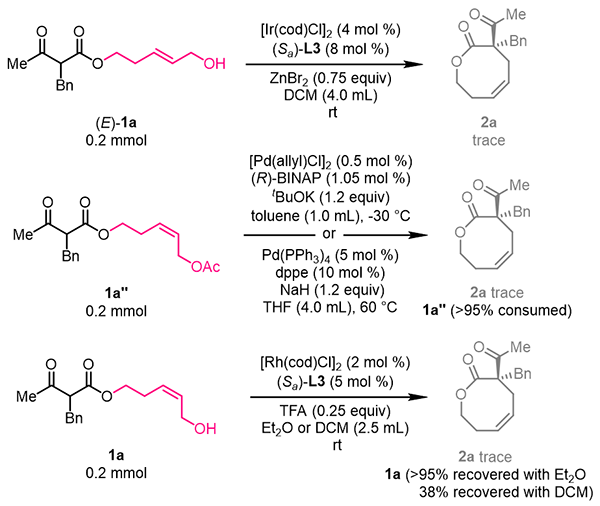
2021年,金属室游书力研究员课题组报道了铱催化Z式保留不对称烯丙基取代反应。利用π-烯丙基铱中间体“π-σ-π”异构化过程相对较慢的特点,使用高活性前手性亲核试剂捕获热力学较不稳定的anti-π-烯丙基铱中间体,以优秀的对映选择性高效合成了一系列高烯丙位具有季碳手性中心的Z式烯烃化合物(Science 2021, 371, 380)。在此基础上,研究人员以连接β-酮酸酯结构单元的Z式烯丙醇为底物,通过合理筛选催化体系和反应条件,以中等到优秀的收率(up to 88%)以及优秀的对映选择性控制(up to 99% ee)实现了一系列手性中环内酯化合物的合成(图2)。该反应操作简便、条件温和,具有良好的官能团容忍性。研究人员发现β-位带有各类吸电子取代基(如酰基、酯基、砜基等)的酯类衍生物均可作为亲核试剂用于该反应,合成八至十一元环内酯类分子。在控制实验中,研究人员发现在标准反应条件下使用E式烯丙醇底物无法获得目标产物。并且研究人员尝试文献已知的钯或铑催化烯丙基取代反应的典型条件也无法得到目标产物。这些结果初步显示了铱催化Z式保留不对称烯丙基取代反应用于合成中环化合物的独特性(图3)。

图2 底物拓展

图3 控制实验
相关的研究结果发表在近期的J. Am. Chem. Soc.期刊上。论文第一作者为丁露博士。上述研究工作得到了科技部、国家自然科学基金委员会、中国科学院、上海市科委和腾讯基金会的资助。
